Эффективность гепатопротекторов при использовании высокодозового метотрексата в лечении детей с остеогенной саркомой
Кобысь В.Л., Коноваленко В.Ф.
Резюме
Проанализированы результаты лечения 31 ребенка с локальной формой остеогенной саркомы, которые получили 121 курс высокодозового метотрексата в дозе 12г/м². Доказано, что комплекс гепатопротекторов (эссенциальные фосфолипиды, липоевая кислота, витамин Е, энтеросорбенты – в среднетерапевтических дозах) ускоряют снижение трансаминаз, интенсифицируя таким образом проведение химиотерапии.
Ключевые слова: остеогенная саркома, высокодозовый метотрексат, трансаминазы, гепатопротекторы.
Вступление
Метотрексат был и остается одним из основных препаратов в лечении больных с остеогенной саркомой[1]. Протоколы полихимиотерапии с использованием высокодозового метотреката показали большую эффективность, чем без высокодозового метотрексата [2]. В настоящее время в лечении остеогенной саркомы в странах Европы и США используется объединенный протокол (Euramoss 1), который так же включает высокодозовый метотрексат [3]. Современные данные свидетельствуют о необходимости применения его у детей в дозе не менее 12 г∕м²[4]. Доказано так же, что эффективность высокодозового метотрексата вместе с цисплатином и доксорубицином зависит от количества курсов в единицу времени (интенсивность химиотерапии). По данным института Риццоли при интенсивности неоадъювантной химиотерапии ≥ 90% плана химиотерапии выживаемость больных на 19,2% больше, чем в группе, у которой план лечения выполнялся меньше, чем на 90% (р<0,02)[5]. Задержкой в проведении очередного курса химиотерапии после использования высокодозового метотрексата часто является гепатотоксичность метотрексата, поскольку уровни трансаминаз больше 200 МЕ/л есть противопоказанием к продолжению химиотерапии [6,7]. При проведении протокола CNR-2 neo c высокодозовым метотрексатом частота повышения трансаминаз больше 350МЕ/л была отмечена у 32% курсов химиотерапии [8]. Причиной повышения трансаминаз является прямое токсическое повреждение клеток печени метотрексатом и его метаболитами [9]. По-этому препараты, восстанавливающие структуру клеток печени (эссенциальные фосфолипиды, липовая кислота и другие) должны использоваться в лечении и профилактике гепатотоксичности [10]. Есть лишь отдельные данные по лечению гепатотоксичности высокодозового метотрексата у детей [11,12]. Целью данной работы было изучить эффективность применения комплекса гепатопротекторов для ускоренного снижения уровня трансаминаз .
Материал и методы исследования
Проведен анализ историй болезней детей, больных локальной формой остеогенной саркомы, которые лечились в институте онкологии АМН Украины, отделении детской онкологии с 1999 по 2006 годы. В исследование включены пациенты, которые получали метотрексат в дозе 12 г/м² в течении 4 часов. Параллельно проводилась инфузионная терапия в объеме 3 л/м² в течение 4 суток, ощелачивание мочи гидрокарбонатом натрия, введение кальция фолината в дозе соответственно шкале R.Kotz. Выделено 2 группы больных. В контрольную группу включены дети, получавшие метотрексат без использования гепатопротекторов, в основную группу – дети с терапией сопровождения гепатопротекторами. Комплекс гепатопротекторной терапии включал: эссенциальные фосфолипиды («эссенциале», «Sanofi Aventis», Франция), липоевую кислоту («берлитион», «Berlin Chemiе», Германия), витамин Е, энтеросорбенты в среднетерапевтических дозах. Всего для анализа было взято показатели Алт у 31 ребенка при проведении 110 курсов высокодозового метотрексата. Распределение по возрасту, полу, количеству проведенных курсов высокодозового метотрексата контрольной и основной групп представлены в таблице 1:
Таблица 1. Распределение больных контрольной и основной групп по полу, возрасту, количеству курсов химиотерапии.
| Контрольная группа (без гепатопротекторов) | Основная группа (с гепатопротекторами) | |
| Количество больных | 19 | 12 |
| Распределение по полу | 8 девочек/11 мальчиков | 6 девочек/6 мальчиков |
| Средний возраст | 12,2 года | 13,6 года |
| Количество курсов химиотерапии | 51 | 59 |
Средний возраст в контролной и основной группах составил 12,2 года и 13,6 года соответственно.
Забор крови проводили до и в течение 7-16 дней после введения метотрексата. Количественное определение трансаминаз проводили методом ФПИА на анализаторе FLx («Abbot», США), количественное определение концентрации метотрексата в крови методом ИФА на анализаторе TDX/FLX («Abbot», США).
Оценку гепатотоксичности проводили по шкале токсичности CTC NCIC (Clinical Toxicity Criteria National Cancer Institut Canada) .
Результаты и их обсуждение
По критериям шкалы токсичности CTC NCIC в 1-й день после инфузии высокодозового метотрексата уровни токсичности в обеих группах показаны в таблице 2.
Таблица 2. Уровни гепатотоксичности в контрольной и основной группах.
| Гепатотоксичность,степень | Контрольная группа, количество курсов | Основная группа, количество курсов |
| 0 | 1 / 2% | 9 / 1,5% |
| 1 | 16 /31% | 15 / 25% |
| 2 | 9 / 17,6% | 11 / 18,5 |
| 3 | 21 / 41% | 20 / 40% |
| 4 | 4 / 8% | 4 / 7% |
| Всего | 51 | 59 |
Как видно из таблицы 2, уровни токсичности сравнимы в обеих группах. На 2 и 3 степень токсичности приходиться большая часть курсов химиотерапии: 58,6% количества курсов контрольной группы и 58,5% количества основной группы.
С учетом таких данных в обеих группах выделены курсы метотрексат-терапии с уровнями показателей АЛТ от 100 до 500 МЕ/л и количеством контрольных замеров АЛТ в одном курсе не менее 3. С помощью компьютерной программы Мicrosoft Оffis Еxel 2003 (Corp. Мicrosoft, США) вычислено отдельно для каждого курса высокодозового метотрексата скорость изменения АЛТ (наклон) по формуле где x и y — выборочные средние значения СРЗНАЧ(массив1) и СРЗНАЧ(массив2).
Полученные данные представлены в таблице 3.
Таблица 3. Скорость изменения АЛТ в основной и контрольной группах.
| № п/п курса химиотерапии | Контрольная группа, скорость изменения АЛТ, МЕ/л | Основная группа, скорость изменения АЛТ, МЕ/л |
| 1. | -19 | -35 |
| 2. | -0,77 | -42,5 |
| 3. | -14 | -13 |
| 4. | -6 | -29 |
| 5. | -13 | -62,9 |
| 6. | -21 | -60,5 |
| 7. | -8,5 | -28 |
| 8. | -10,5 | -40,7 |
| 9. | -29,5 | -52 |
| 10. | -24 | -34 |
| 11. | -16 | -20 |
| 12. | -23 | -14 |
| 13. | -11 | -42 |
| 14. | -16 | -17,3 |
| 15. | -11 | -30,1 |
| 16. | -30,4 | -32 |
| 17. | -11 | -43 |
| 18. | -72 | |
| 19. | -57 |
В графической форме показатели снижения АЛТ основной и контрольной групп представлены на рис.1:
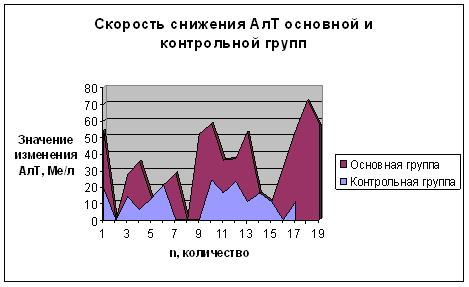
Для сравнения данных двух групп использован Т-критерий для независимых выборок. Обработка данных проведена с помощью программы Statistica (версия 6.0, Statsoft Inc., США), которые представлены в таблице 4:
Таблица 4. Т-критерий сравнения снижения показателя АЛТ контрольной и основной групп.
| Mean | Mean | t-value | df | p | Valid N | Valid N | Std.Dev. | Std.Dev. | F-ratio | p | |
| Var1 vs. Var2 | -15.5100 | -38.1474 | 5.011122 | 34 | 0.000017 | 17 | 19 | 8.100853 | 16.95636 | 4.381308 | 0.004650 |
Из полученых данных видно, что использование комплекса гепатопротекторов достоверно (р=0,000017) увеличивает скорость снижения АЛТ в основной группе по сравнению с контрольной. Графически средние значения скорости снижения АЛТ контрольной и основной групп представлены на рис.2.
Рис2. Средние значения скорости снижения АЛТ контрольной и основной групп:
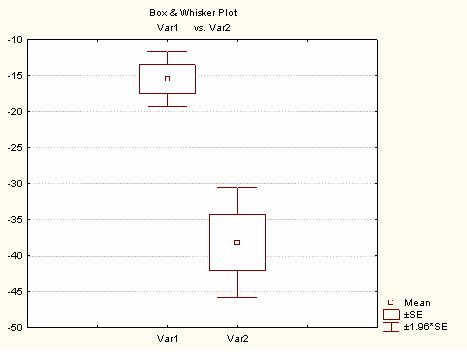
При анализе данных АЛТ контрольной и основной групп от 500 МЕ/л и выше достоверной разницы между группами выявлено не было, поскольку гепатопротекторная терапия проводилась в обеих группах, хотя в контрольной и не использовался весь комплекс гепатопротекторной терапии.
Выводы
Таким образом, использование гепатопротекторов при проведении высокодозового метотрексата достоверно быстро приводит к снижению АЛТ. Это интенсифицирует проведение очередного курса химиотерапии, повышая таким образом эффективность использования высокодозового метотрексата.
Литература
1. Ferrari S, Рalmerini E.Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma.//Curr Opin Oncol. 2007 Jul;19(4):341-6.
2. Biology and Therapeutic advances for pediatric osteosarcoma / Neyssa Marinaa, Marc Gebhardtb, Lisa teotc et al.//The Oncologist.-2004.Vol.9, №4.-P.422-441.
3. Stefan Bielack, Jenniy Potratz, Herbert Jürgens. Osteosarcome bei Kindern, jugendlichen und Erwachsenen: Diagnostic, interdisciplinäre Therapie und Nachsorge.// Journal of Onkologie.-2004.- №8.
4. High-dose methotrexate pharmacokinetics and outcome of children and young adults with osteosarcoma./ Crews KR, Liu T, Rodriguez-Galindo C, et al.// Cancer. 2004 Apr 15;100(8):1724-33
5. Relationship between dose-intensity of treatment and outcome for patients with osteosarcoma of the extremity treated with neoadjuvant chemotherapy./ Bacci G., Ferrari S., Longhi A. et al.//. Oncol. Rep. 2001. Jul-Aug; 8(4): 883-8.
6. Переводчикова Н.И. (ред.) 2005 Химиотерапия опухолевых заболеваний . Краткое руководство. Медицина, Москва.
7. Cooperative Osteosarcomstudie COSS – 96. Therapieprotokoll der Geseltschaft für Pädiatrische Onkologie und Hämatologie
8. Toxicity of high dose methotrexate repeated infusions in children treated for acute lymphoblastic leukemia and osteosarcoma./ Ridolfi L, Barisone E, Vivalda M, et al.// Minerva Pediatr. 1996 May;48(5):193-200.
9. Acute hepatotoxicity after high-dose methotrexate administration to rats./ Bremnes RM, Smeland E, Huseby NE, et al.// Pharmacol Toxicol. 1991 Aug;69(2):132-9.
10. Е.А. Ушкалова. Место эссенциальных фосфолипидов в современной медицине../Фарматека.2004 год, №10 (73)
11. Н.А.Степанова. Биокинетические параметры показателей токсичности высоких доз метотрексата./Журнал Российской ассоциации по спортивной медицине и реабилитации больных и инвалидов №2 (22) 2007 с.57
12. Изучение токсичности терапии высокими дозами метотрексата у детей с остеосаркомой./ Кошечки К.А., Иванов А.В., Савлаев К.Ф// Материалы 14 Всероссийской конференции «Человек и лекарство», апрель 2007 года , с.706









