Застосування метотрексату в надвисоких дозах для лікування дітей із злоякісними новоутвореннями кісток
Кобись В.Л.,Климнюк Г.І.,Шайда О.В., Жукова В.М., Нечваль В.М., Лоторєва О.Є.
Резюме
38 дітей віком від 8 до 16 років отримували в комплексному лікуванні злоякісних пухлин метотрексат в дозі 12 г/м². За даними біохімічного аналізатору TDX/FLX методом імунофлюоресцерції проводилось щодобове спостереження за рівнем хіміопрепарату в сироватці крові та призначення достатніх доз кальцію фолінату. Летальних випадків не було. Ускладнення спостерігались у вигляді шкірних реакцій, гепатотоксичності 1-4 ступеня, затримці виведення метотрексату, помірно вираженого гастроінтестінального та мієлосупресивного ефекту.
Отримані результати свідчать про добру переносимість препарату у дітей та його безпечність при умові апаратного моніторування за його виведенням, забезпечення достатнього рівня діурезу, залужнення сечі, призначення достатньої за тривалістю та дозою фолінату кальцію .
Вступ
Метотрексат для проведення хіміотерапії почали застосовувати в 50-х роках XX сторіччя. В 1972-74 роках вперше опубліковані дані про позитивний ефект в лікуванні хворих з легеневими метастазами метотрексатом в високих (більше 100 мг/м²) (1-3). Згодом метотрексат в надвисоких дозах (8 г/м²) почали застосовувати для лікування хворих з локальними формами остеосаркоми (4,5). В 1992 р. отримали дані про більшу ефективність метотрексату за умови утворення його концентрації в крові більше 1000 мкмоль/л, що забезпечувалось його призначенням у дозі 12 г/м²(6-9). Саме такі дози препарату рекомендують в сучасних протоколах лікування остеосаркоми у дітей (COSS-96, ISG-SSG I) . Виживаність хворих при їх лікуванні метотрексатом в надвисоких дозах складає від 70 до 80% (10, 11). Цей препарат вважається одним з основних в лікуванні хворих на остеосаркому.
Даних про переносимість препарату в дозі 12 г/м² у дітей мало (12), практичне використання метотрексату в надвисоких дозах в нашій країні нами було застосовано вперше. Тому отримані результати використання метотрексату в надвисоких дозах у лікуванні дітей із злоякісними новоутвореннями кісток мають як наукову так і практичну цінність.
Мета роботи – визначити ефективність та безпечність застосування метотрексату в надвисоких дозах у лікуванні хворих дітей на злоякісні новоутворення кісток.
Матеріал та методи дослідження
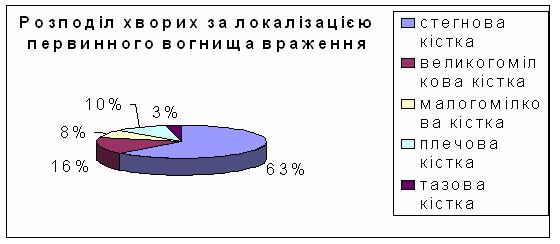
За період з 1999 по 2004 рік в дитячому відділенні інституту онкологіії АМН України було застосовано метотрексат в надвисоких дозах (12г/м²) у лікуванні 38 дітей у віці від 8 до 16 років із злоякісними новоутвореннями кісток (рис.1) :

Рис.2. Локалізація первинного вогнища злоякісного новоутворення:
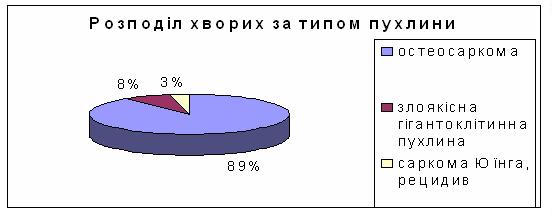
Розподіл за стадією хвороби: 2в – 33 хворих (87% ), 4 стадії – 5 хворих (13%). Розподіл за типом пухлини був таким: остеогенна саркома у 34(91%), злоякісна гігантоклітинна пухлина у 2 хворих (6%), рецидив саркоми Юїнга у 1 хворого (3%) – (див. рис.3):
Кількість проведених курсів високодозового метотрексату у 1 хворого складала від 1 (рецидив з прогресуванням саркоми Юїнга кісток тазу) до 14 ( лікування остеосарком за протоколом, розробленим в клініці дитячої онкології ), всього проведено 396 курсів.
Дозовий режим
Вводили метотрексат у дозі 12 г/м² 1 раз на 8 днів протягом 4- годинної інфузії з натрієм гідрокарбонатом в дозі 120 ммоль/ м²/добу для забезпечення рівня залужнення сечі в межах ph ≈ 7 та водною підтримкою діурезу 3 л/ м² 1-4 день інфузії розчином 5% глюкози з калієм хлоридом 60 mmol/ м²/добу. Водний баланс контролювали на рівні “0”.При позитивному балансі рідини (більше 200 мл/м²за 6 та за 12 годин) вводили фурасемід в дозі 0,5-1 мг/кг внутрішньовенно струминно.
Критеріями для початку проведення хіміотерапії були: загальний задовільний стан, рівень гемоглобіну крові більше 76 г/л, тромбоцитів більше 80·109/л, нейтрофільних гранулоцитів більше 1000·109 /л, активність АлТ та АсТ нижче 180 МЕ.
Лікування високодозовим метотрексатом супроводжувалось щодобовим погодинним визначенням рівня метотрексату в сироватці крові через 4 години від початку інфузії метотрексату (Т4), через 1 добу, 2 ,3 ,4 доби ( Т48 ,Т72 ,Т96) від моменту початку введення метотрексату. Визначення метотрексату в сироватці крові проводили на апараті „TDX” виробництва США.
Результати та їх обговорення
Середні значення концентрацій метотрексату в сироватці крові були такими: Т4 – 1100±150 мкмоль/л,Т48 – 5,5±1,5 мкмоль/л, Т 72 – 0,2±0,05 мкмоль/л l, Т96 – 0,07±0,02 мкмоль/л, що відповідає кривій виведення метотрексату за Kotz (13). В окрему групу умовно було виділено 5 хворих (13%), рівні концентрацій метотрексату яких через добу (Т24) були вищими 20 мкмоль/л.Тривалість виведення метотрексату була більшою, від 5 до 14 діб. Середні значення концентрацій для цієї групи хворих були такими: Т4 – 1200±150 мкмоль/л,Т48 – 45,5±4,5 мкмоль/л, Т 72 – 2,5±0,5 мкмоль/л, Т96 – 0,7±0,06 мкмоль/л.
Призначення дози кальцію фоліанту у всіх випадках було згідно кривої виведення метотрексату за Kotz.
Ускладнення
Летальних випадків, зумовлених ускладненнями хіміотерапії високодозовим метотрексатом- не було.
В перші години інфузії метотрексату у 5 (13%)дітей спостерігалась шкірна реакція в вигляді пятнисто-папульозної висипки на шкірі обличчя, тулуба, кінцівок та супроводжувалась шкірним зудом. Це потребувало призупинення інфузії метотрексату на 15- 30 хвилин та введення внутрішньовенно кортикостероїдів та антигістамінних препаратів. У всіх випадках реакція була купована.
Хіміотерапія продовжена, крім одного пацієнта, в якого була переоцінена загальна токсичність за браком досвіду
Оцінку токсичності проводили за шкалою токсичності – критерії CTC-NCIC (Clinical Trial Centre National Institute Canada) (14).
Підтвердження токсичного ураження печінки після інфузії високодозового метотрексату виявили через 1 добу за результатами дослідження активності АлТ та АсТ до 3000МЕ, рівня білірубіну до 76 мкмоль/л. Печінкова токсичність 4 ступеня була виявлена в 10 % випадків, 3 ступеня в 75 %, 2 ступеня в 7% , 1 ступеня 5 %, відсутність гепатотоксичності в 3% з 396 проведених курсів хіміотерапії. Для лікування у дітей гепатопатії проводився комплекс загальноприйнятої гепатопротекторної терапії із включенням есенціале , ліпоєвої кислотиа, вітаміну Є, ентеросорбентів, гептралу. За високих рівнях активності Алт та АсТ (більше 1000МЕ) додатково призначали глюкокортикостероїди у дозі 1 мг/кг впродовж 3 10 діб.
Затримку виведення метотрексату( концентрація метотрексату в крові більше 0,2 мкмоль/л на 4 добу від початку введення метотрексату – Т96) спостерігали в 10 випадках курсів хіміотерапії (2,5%) у 5 хворих.Пацієнти отримували інфузійну терапію, лейковорін,гепатопротекторну терапію. Гастроінтестинальна токсичність 1-3 ступеня в вигляді нудоти, блювоти спостерігали протягом 1-3 доби після хіміотерапії у 85% курсів хіміотерапії. Протиблювотну терапію проводили за загальноприйнятою схемою. Стоматит 1 ступеня важкості спостерігали в 7 випадках (2% з усіх курсів хіміотерапії). З метою профілактики стоматиту під час інфузії метотрексату проводилось регіональне охолодження слизової порожнини рота.
Гематологічна токсичність проявлялась лейкопенією різного ступеня на 8-14 добу після проведення хіміотерапії. Лейкопенія 1 ступеня виявлялась у 20 випадках (5%), 2 ступеня у 8 випадках (2%), 3 ступеня у 8 випадках (2%), 4 ступеня у 4 випадках (1%).
Таким чином, за частотою побічних дій під час проведення хіміотерапії високодозовим метотрексатом на першому місці є гепатотоксичність – 98% курсів хіміотерапії, гастроінтестинальна токсичність за частотою на другому місці – 85%,шкірна токсичність в вигляді п´ятнисто – папульозної висипки в 13% – третя за частотою, гематологічна токсичність в 10% – четверта .
Висновки
Отриманий нами клінічний досвід проведення хіміотерапії високодозовим метотрексатом свідчить про добру переносимість препарату у дітей та його безпечність застосування при умові аппаратного моніторування за його виведенням, забезпечення достатнього рівня діурезу, залужнення сечі, призначення достатньої дози кальцію фолінату та тривалості його застосування, проведення адекватної гепатопротекторної та протиблювотної терапії.
Висока частота токсичних проявів потребує подальше вдосконалення гепатопротекторної терапії, розробки більш ефективних протиблювотних препаратів , розробки препаратів, що покращують виведення метотрексату з крові.
Література
1. Jaffe, N., Farber, S., Traggis, D., Geiser, C., Das, L., Kim, J., Frauenberger, G. and Djerassi, I.: Favorable Response of Metastatic Osteogenic Sarcoma to Pulse High Dose Methotrexate Citrovorum Administration (HDMC). Proc. AACR 13:27, 1972.
2. Jaffe, N.: Recent Advances in the Chemotherapy of Metastatic Osteogenic Sarcoma. Cancer, Vol. 30, No. 6, pp. 1627-1631, 1972.
3. Jaffe, N., Farber, S., Traggis, D., Djerassi, I., et all: Favorable Response of of Metastatic Osteogenic Sarcoma to Pulse High Dose Methotrexate with Citrovorum Frescue and Radiation Therapy. Cancer 31:1367-1373, 1973.
4. Jaffe, N., Frei, E., Traggis, D., and Bishop, Y.: Adjuvant Methotrexate and and Citrovorum-Factor Treatment of Osteogenic Sarcoma. The New England Journal of Med., Vol. 291, No. 19, pp. 994-997, 1974.
5. Rosen, G., Suwansirikul, S., Kwon, c., Tan, C., Wu., J., Beattie, E., , and Murphy, M.: High-Dose Methotrexate with Citrovorum Factor Rescue and Adriamycin in Childhood Osteogenic Sarcoma. Cancer 33:4,p.1151-1163,1974.
6. Delepine,N., Comille,H., Brun,B., Alkallaf,S.,Markowska,B., Delepine,G.:Long-term results of comprehensive treatment for non-meta_static primary limb high-grade osteosarcoma (O.S.). Emphasis of escalating high dose methotrexate (HDMTX). Journal of Cancer, Supplement 13, 2002, p.429.
7. Kawai A; Sugihara S; Kunisada T; Hamada M; Inoue H: The importance of doxorubicin and methotrexate dose intensity in the chemotherapy of osteosarcoma. Arch Orthop Trauma Surg, 4:68-70, 1996
8. Bacci G; Ferrari S; Picci P; Zolezzi C; Gherlinzoni F; Iantorno D; Cazzola A: Methotrexate serum concentration and histological response to multiagent primary chemotherapy for osteosarcoma of the limbs.J Chemother, 8:472-8, 1996 Dec
9. Delepine N; Delepine G; Bacci G; Rosen G; Desbois JC . Influence of methotrexate dose intensity on outcome of patients with high grade osteogenic osteosarcoma. Analysis of the literature [see comments]. Cancer, 8:2127-35, 1996 Nov 15.
10. Rosen G.,Caparros B.,Huvos A., et al. Preoperative chemotherapy for osteosarcoma. Selection of postoperative adjuvant chemotherapy based on response of primary tumor to preoperative chemotherapy. Cancer 1982.49:1221-1239.
11. Winkler K., Beron G.,Delling G., et al: Results of a randomised cooperative trial (COSS-82) with salvage chemotherapy based on histological tumor response . J Clin Oncol 1988, 6: 329-337.
12. Weber BL., Tanyer G., Poplack DG., et al. Transient acute hepatotoxicity of high-dose methotrexate therapy during childhood. NCI Monogr. 1987,5:207-212.
13. Krisch K, Kotz R,Mehta BM: Zur Methotrexatspiegelbesstimmung im serum mit einem mikrobiologischen Test nach hochdosierter Methotrexat-behandlung Wiener. Klin Wchschr 89:479-481, 1977.
14. Химиотерапия опухолевых заболеваний.Краткое руководство под редакцией Н.И.Переводчиковой.Москва, „Медицина”, 2000, стр.364-371.









